|
Nikel
Nikel adalah unsur kimia metalik dalam tabel periodik yang memiliki simbol Ni dan nomor atom 28. Nikel adalah logam berwarna putih keperak–perakan sedikit semburat keemasan. Nikel termasuk logam transisi, dan memiliki sifat keras serta ulet.[4] Nikel juga tergolong dalam grup logam besi-kobalt, yang dapat menghasilkan paduan yang sangat berharga.[5] Nikel murni berbentuk bubuk untuk memaksimalkan luas permukaan reaktif, memiliki aktivitas kimia yang signifikan, tetapi potongan yang besar lambat bereaksi dengan udara dalam kondisi normal karena lapisan teroksidasi terbentuk di permukaan dan mencegah korosi lebih lanjut (pasivasi). Meski begitu, nikel murni hanya ditemukan di kerak bumi dalam jumlah kecil, biasanya di batuan ultrabasa,[6][7] dan di dalam meteorit besi atau siderit yang tidak terpapar oksigen saat berada di luar atmosfer Bumi. Nikel di dalam meteorit ditemukan bersama dengan besi, yang berasal dari supernova. Campuran besi–nikel diperkirakan menyusun inti luar dan inti dalam bumi.[8] Penggunaan nikel (sebagai paduan nikel-besi) dimulai sejak 3500 SM. Nikel pertama kali diklasifikasikan sebagai unsur kimia pada tahun 1751 oleh Axel Fredrik Cronstedt, yang awalnya mengira bijih tersebut sebagai mineral tembaga, di tambang kobalt di Los, Hälsingland, Swedia. Nama elemen ini berasal dari peri nakal dari mitologi penambang Jerman, Nickel (mirip dengan Nick Lama), yang mempersonifikasikan fakta bahwa bijih tembaga–nikel tidak bisa dimurnikan menjadi tembaga. Sumber nikel yang penting secara ekonomi adalah bijih besi limonit, yang mengandung 1–2% nikel. Mineral bijih nikel penting lainnya termasuk pentlandit dan campuran silikat alami yang kaya nikel yang dikenal sebagai garnierit. Lokasi produksi utama terletak di wilayah Sudbury di Kanada (yang diperkirakan berasal dari meteorit), Kaledonia Baru, dan Norilsk di Rusia. Nikel secara perlahan teroksidasi oleh udara pada suhu normal dan dianggap tahan korosi. Dalam sejarah, nikel digunakan untuk pelapisan besi dan kuningan, melapisi peralatan kimia, dan membuat paduan tertentu yang mempertahankan polesan perak tinggi, seperti perak Jerman. Sekitar 9% digunakan untuk lapisan nikel tahan korosi. Benda yang dilapisi nikel terkadang memicu alergi nikel. Nikel banyak digunakan dalam uang logam, walaupun kenaikan harga telah menyebabkan penggantian nikel dengan logam yang lebih murah dalam beberapa tahun terakhir. Nikel adalah salah satu dari empat elemen (yang lainnya adalah besi, kobalt, dan gadolinium)[9] yang bersifat feromagnetik pada suhu normal. Magnet permanen Alnico yang mengandung nikel memiliki kekuatan sedang antara magnet permanen besi dan magnet tanah jarang. Perpaduan nikel, krom dan besi menghasilkan baja tahan karat (stainless steel) yang banyak diaplikasikan pada peralatan dapur (sendok, dan peralatan memasak), ornamen-ornamen rumah dan gedung, serta komponen industri. Nikel penting pada zaman modern, terutama untuk paduan; sekitar 68% digunakan untuk baja tahan karat. 10% digunakan untuk paduan nikel–tembaga, 7% untuk baja paduan, 3% untuk pengecoran, 9% untuk pelapisan dan 4% dalam penggunaan lain, yang termasuk sektor baterai yang cepat berkembang.[10] Sebagai suatu senyawa, nikel memiliki kegunaan pembuatan bahan kimia khusus, seperti katalis untuk hidrogenasi (untuk ini digunakan nikel Raney), katoda untuk baterai, pigmen, dan perawatan permukaan logam.[11] Nikel merupakan nutrisi yang penting untuk sebagian mikroorganisme dan tumbuhan yang memiliki enzim dengan nikel sebagai situs aktifnya. KarakteristikSifat atom dan fisik Nikel adalah logam putih keperakan dengan sedikit semburat keemasan dengan polesan tinggi. Ini adalah salah satu dari empat elemen yang bisa menjadi magnet pada atau mendekati suhu kamar, bersama dengan besi, kobalt, dan gadolinium, jika didekatkan dengan sebuah magnet. Suhu Curie nikel adalah 355 °C (671 °F), artinya nikel menjadi non-magnetis diatas suhu Curie.[13] Sel satuan nikel adalah kubus-berpusat muka dengan parameter kisi 0,352 nm, yang membentuk jari-jari atom 0,124 nm. Struktur kristal ini stabil pada tekanan lebih dari 70 GPa. Nikel termasuk dalam kelompok logam transisi. Nikel memiliki sifat keras, mudah dibentuk dan ulet, dan memiliki konduktivitas listrik dan panas yang relatif tinggi untuk logam-logam transisi.[4] Kekuatan tekan nikel yang tinggi sebesar 34 GPa, diperkirakan bisa membuat kristal ideal, tidak pernah diperoleh dalam material sebenarnya karena pembentukan dan pergerakan dislokasi; namun, tekanan itu telah dicapai dalam nanopartikel Ni.[14] Konfigurasi elektronAtom nikel memiliki dua konfigurasi elektron, [Ar] 3d8 4s2 dan [Ar] 3d9 4s1. Jumlah energinya sangat dekat - simbol [Ar] mengacu pada struktur inti yang berbentuk seperti argon. Ada beberapa ketidaksepakatan tentang konfigurasi yang memiliki energi paling rendah.[15] Buku pelajaran kimia mengutip konfigurasi elektron nikel sebagai [Ar] 4s2 3d8,[16] bisa ditulis sebagai [Ar] 3d8 4s2.[17] Konfigurasi ini sesuai dengan aturan urutan energi Madelung, yang memprediksi 4s terisi sebelum 3d. Hal ini didukung oleh fakta eksperimental bahwa tingkat energi terendah dari atom nikel adalah tingkat energi 3d8 4s2, khususnya tingkat energi 3d8 (3F) 4s2 3F, J = 4.[18] Namun, masing-masing dua konfigurasi terbagi menjadi beberapa tingkat energi karena struktur yang halus,[18] dan kedua kelompok tingkat energi tersebut tumpang tindih. Energi rata-rata tingkat dengan konfigurasi [Ar] 3d9 4s1 lebih rendah daripada energi rata-rata tingkat dengan konfigurasi [Ar] 3d8 4s2. Karena ini, penelitian tentang perhitungan atom mengutip konfigurasi tingkat dasar nikel sebagai [Ar] 3d9 4s1.[15] IsotopBobot atom setiap isotop nikel berkisar dari 48 u (48Ni) sampai 78 u (78Ni). Nikel yang dapat ditemukan secara alami terdiri dari lima isotop stabil; 58Ni, 60Ni, 61Ni, 62Ni dan 64Ni. Isotop 58Ni paling banyak ditemukan (68.077% kelimpahan alami). Isotop yang lebih berat dari 62Ni tidak dapat dibentuk dengan fusi nuklir tanpa kehilangan energi untuk fusi. Nikel-62 memiliki energi pengikatan inti rata-rata tertinggi per nukleon dari setiap nuklida, pada 8,7946 MeV/nukleon.[19] Energi ikatnya lebih besar dari 56Fe dan 58Fe, unsur-unsur yang lebih banyak ditemukan daripada 62Ni yang sering salah dikutip sebagai memiliki nuklida yang memiliki ikatan paling erat.[20] Walaupun ini memprediksi nikel-62 sebagai unsur berat paling banyak di alam semesta, tingkat fotodisintegrasi nikel yang relatif tinggi di dalam bintang menyebabkan besi menjadi elemen yang paling melimpah.[20] Isotop stabil nikel-60 adalah produk dari radionuklida besi punah 60Fe, yang meluruh dengan waktu paruh 2,6 juta tahun. Karena 60Fe memiliki waktu paruh yang sangat lama, persistensi Fe pada material di tata surya dapat menghasilkan variasi komposisi isotop 60Ni yang dapat dideteksi. Oleh karena itu, kelimpahan 60Ni di benda luar angkasa dapat memberikan wawasan tentang asal-usul tata surya dan sejarahnya. Setidaknya 26 radioisotop nikel telah ditemukan, yang paling stabil adalah 59Ni dengan waktu paruh 76.000 tahun, 63Ni dengan waktu paruh 100 tahun, dan 56Ni dengan waktu paruh 6 hari. Semua sisa isotop radioaktif memiliki waktu paruh kurang dari 60 jam dan sebagian besar memiliki waktu paruh kurang dari 30 detik. Elemen ini juga memiliki satu status meta.[21] Nikel-56 yang radioaktif diproduksi melalui proses pembakaran silikon dan kemudian dibebaskan dalam jumlah besar dalam supernova tipe Ia. Bentuk kurva cahaya supernova ini pada masa-tengah hingga akhir berhubungan dengan peluruhan melalui penangkapan elektron nikel-56 menjadi kobalt-56 dan akhirnya menjadi besi-56.[22] Nickel-59 adalah radionuklida kosmogenik dengan umur panjang dengan waktu paruh 76.000 tahun. 59Ni memiliki banyak kegunaan dalam geologi isotop. 59Ni telah digunakan untuk menentukan umur meteorit di bumi dan untuk menentukan kelimpahan debu luar angkasa dalam es dan sedimen. Waktu paruh nikel-78 adalah 110 milidetik, dan diyakini sebagai isotop penting dalam nukleosintesis (pembuatan) dalam supernova unsur yang lebih berat daripada besi.[23] Nuklida 48Ni, ditemukan pada tahun 1999, adalah isotop unsur berat yang memiliki proton yang paling banyak diketahui. Dengan 28 proton dan 20 neutron, 48Ni memiliki "bilangan ajaib ganda", seperti halnya 78Ni dengan 28 proton dan 50 neutron. Oleh karena itu, keduanya stabil untuk sebuah nuklida dengan ketidakseimbangan proton-neutron yang besar.[21][24] Keberadaan Di Bumi, nikel paling sering muncul dengan belerang dan besi di dalam mineral pentlandit, dengan belerang di dalam mineral millerit, dengan arsen di dalam mineral nikelin, dan dengan arsen dan belerang di dalam galena nikel.[25] Nikel banyak ditemukan pada meteorit besi atau siderit sebagai mineral kamasit dan taenit. Nikel menjadi ciri komponen yang membedakan meteorit dari mineral lainnya.[5] Meteorit besi atau siderit dapat mengandung alloy besi dan nikel berkadar 5-25%.[5] Keberadaan nikel dalam meteorit pertama kali ditemukan pada tahun 1799 oleh Joseph-Louis Proust, seorang ahli kimia dari Prancis yang kemudian bekerja di Spanyol. Proust menganalisis sampel meteorit dari Campo del Cielo (Argentina), yang diperoleh pada tahun 1783 oleh Miguel Rubín de Celis. Dia menemukan nikel (sekitar 10%) bersama dengan besi di meteoritnya.[26] Sebagian besar nikel ditambang dari dua jenis deposit bijih, yaitu laterit, dengan limonit nikel sebagai campuran mineral bijih utama, (Fe,Ni)O(OH), dan garnierit (campuran berbagai nikel hidro dan silikat kaya nikel), dan endapan sulfida magmatik, di mana mineral bijih utamanya adalah pentlandit: (Ni,Fe)9S8. Indonesia dan Australia diperkirakan memiliki cadangan terbesar, yaitu 43,6% dari total cadangan dunia.[27] Sumber daya alam yang sudah diidentifikasi dengan rata-rata 1% nikel atau lebih mengandung 130 juta ton nikel (sekitar dua kali lipat dari cadangan yang diketahui). Sekitar 60% berada di dalam mineral laterit dan 40% di dalam endapan sulfida.[28] Berdasarkan bukti geofisika, sebagian besar nikel di Bumi berada di inti luar dan dalam Bumi. Kamasit dan taenit adalah paduan besi dan nikel yang terbentuk secara alami. Untuk mineral kamasit, paduan besi dan nikel biasanya dalam proporsi 90:10 hingga 95:5, walaupun material lain (seperti kobalt atau karbon) mungkin ada, sedangkan untuk mineral taenit, kandungan nikelnya berkisar antara 20% dan 65%. Mineral kamasit dan taenit juga ditemukan di meteorit besi-nikel.[29] Sifat lainNikel adalah logam yang ringan, mudah ditempa, sedikit ferromagnetis, dan merupakan konduktor yang agak baik terhadap panas dan listrik.[5] Nikel juga tahan terhadap oksidasi, mudah ditarik oleh magnet, larut dalam asam nitrit, tidak larut dalam air dan amonia, dan sedikit larut dalam hidroklorik dan asam belerang.[5] Rapat jenisnya 8,902, dan berat jenis 8,8 untuk logam padat dan 9,04 untuk kristal tunggal.[5] SenyawaBilangan oksidasi nikel yang paling banyak ditemui adalah +2. Senyawa Ni0, Ni+, dan Ni3+ telah diketahui dengan baik, dan bilangan oksidasi exotis Ni2−, Ni1−, dan Ni4+ telah diproduksi dan dipelajari.[30] Nikel(0)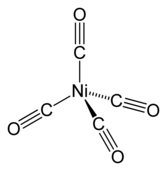 Nikel tetrakarbonil (Ni(CO)4) adalah cairan yang mudah menguap dan sangat beracun pada suhu ruangan. Nikel tetrakarbonil ditemukan oleh Ludwig Mond.[31] Saat dipanaskan, kompleksnya terurai kembali menjadi nikel dan karbon monoksida: Ni(CO)4 ⇌ Ni + 4 CO Perilaku ini digunakan dalam proses Mond untuk memurnikan nikel, seperti dijelaskan di atas. Nikel(0) kompleks bis(siklooktadiena)nikel(0) yang terkait adalah katalis yang berguna dalam kimia organonikel karena ligan siklooktadiena (atau kod) mudah tergeser. Nikel(I)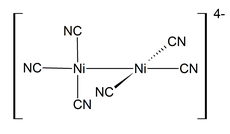 Kompleks nikel(I) jarang ditemukan, salah satu contohnya adalah kompleks tetrahedral NiBr(PPh3)3. Banyak kompleks nikel(I) memiliki ikatan Ni-Ni, seperti K4 [Ni2(CN)6], yang diamagnetik dan berwarna merah tua, disiapkan dengan mereduksi K2[Ni2(CN)6] dengan amalgam natrium (paduan raksa dan natrium). Senyawa ini teroksidasi dalam air, yang membebaskan H2.[32] Telah diperkirakan bahwa bilangan oksidasi nikel(I) penting untuk enzim yang mengandung nikel, seperti [NiFe]-hidrogenase, yang mengkatalisis reduksi reversibel proton menjadi H2.[33] Nikel(II) Nikel(II) membentuk senyawa dengan semua anion umum, termasuk sulfida, sulfat, karbonat, hidroksida, karboksilat, dan halida. Nikel(II) sulfat diproduksi dalam jumlah besar dengan melarutkan logam nikel atau oksida dalam asam sulfat, membentuk hexa- dan heptahidrat[34] yang berguna untuk pelapisan nikel elektrik. Garam umum nikel, seperti klorida, nitrat, dan sulfat, larut dalam air menghasilkan larutan hijau dari logam kompleks aquo [Ni(H2O)6]2+. Keempat halida tersebut membentuk senyawa nikel, yaitu padatan dengan molekul yang memiliki pusat Ni oktahedral. Nikel(II) klorida paling banyak ditemui, dan perilakunya seperti halida lainnya. Nikel(II) klorida diproduksi dengan melarutkan nikel atau oksidanya dalam asam klorida. Biasanya dijumpai sebagai heksahidrat hijau, rumusnya biasanya ditulis NiCl2•6H2O. Ketika dilarutkan dalam air, garam ini membentuk logam kompleks aquo [Ni(H2O)6]2+. Dehidrasi NiCl2•6H2O menghasilkan NiCl2 anhidrat berwarna kuning.[35]  Beberapa kompleks nikel(II) tetrakoordinat, misalnya bis(triphenylphosphine)nikel klorida, ada dalam geometri tetrahedral dan bujur sangkar. Kompleks tetrahedral bersifat paramagnetik, sedangkan kompleks bidang persegi diamagnetik. Dalam memiliki sifat kesetimbangan magnet dan pembentukan kompleks oktahedral, keduanya berbeda dengan kompleks divalen dari logam golongan 10 yang lebih berat, yaitu paladium(II) dan platinum(II), yang hanya membentuk geometri bidang persegi.[30] Nickelocene dikenal memiliki 20 elektron. Ini menjadikan nickelocene relatif tidak stabil.[butuh rujukan] Nikel(III) dan (IV) Ada beberapa senyawa Ni(III) yang telah diketahui, contohnya adalah Nikel(III) trihalofosfin (NiIII(PPh3)X3).[36] Ni(III) membentuk garam sederhana dengan fluorida[37] atau ion oksida. Ni(III) dapat distabilkan oleh ligan σ-donor seperti tiol dan fosfina.[32] Ni(IV) terdapat dalam campuran BaNiO3 oksida, sedangkan Ni(III) terdapat dalam nikel oksida hidroksida, yang digunakan sebagai sebuah katode dalam banyak baterai isi ulang, termasuk jenis baterai nikel-kadmium, nikel-besi, nikel hidrogen, dan nikel metal hidrida, dan digunakan oleh produsen baterai Li-ion tertentu.[38] Ni(IV) merupakan bilangan oksidasi dari nikel yang langka dan sangat sedikit senyawa telah diketahui hingga saat ini.[39][40][41][42] SejarahKarena bijih nikel mudah disalahartikan sebagai bijih perak, pemahaman tentang logam ini dan penggunaannya hanya ada sejak abad pertengahan. Namun, penggunaan nikel yang tidak disengaja telah ditemukan sejak 3500 SM. Perunggu dari Suriah mengandung 2% nikel.[43] Beberapa manuskrip Tiongkok kuno menunjukkan bahwa "tembaga putih" (kupronikel/nikolit), dikenal sebagai baitong) digunakan di Tiongkok antara 1700–1400 SM. Tembaga putih Paktong ini diekspor ke Inggris pada awal abad ke-17, tetapi kandungan nikel dari paduan ini baru ditemukan pada tahun 1822.[44] Koin paduan nikel-tembaga dicetak oleh raja Baktria Agathocles, Euthydemus II dan Pantaleon pada abad ke-2 SM, mungkin dari kupronikel dari Tiongkok.[45]  Di Jerman, pada abad pertengahan, mineral merah ditemukan di Erzgebirge (Pegunungan Ore) yang menyerupai bijih tembaga. Namun, ketika penambang tidak dapat mengekstraksi tembaga apapun, mereka menyalahkan peri nakal dari mitologi Jerman, Nikel (mirip dengan Nick Tua), untuk menimpa tembaga. Mereka menyebut bijih ini Kupfernickel dari bahasa Jermannya Kupfer untuk tembaga.[46][47][48][49] Bijih ini sekarang dikenal sebagai nikelin, yaitu mineral arsenida nikel. Pada 1751, Baron Axel Fredrik Cronstedt mencoba mengekstraksi tembaga dari kupfernickel di sebuah tambang kobalt di desa Los, Swedia. Dia tidak bisa menghasilkan tembaga, namun sebagai gantinya menghasilkan logam putih yang dia beri nama sesuai dengan peri yang memberikan namanya ke mineralnya, nikel.[50] Dalam bahasa Jerman modern, Kupfernickel atau Kupfer-Nickel menunjukkan paduan kupronikel.[4] Awalnya, nikel hanya berasal dari Kupfernickel yang langka. Mulai tahun 1824, nikel diperoleh sebagai produk sampingan dari produksi pewarna biru kobalt. Peleburan nikel skala besar dimulai di Norwegia pada tahun 1848 dari pirhotit yang kaya nikel. Penambahan nikel dalam produksi baja pada tahun 1889 meningkatkan permintaan nikel, dan endapan nikel di Kaledonia Baru, ditemukan pada tahun 1865, menyediakan sebagian besar pasokan nikel dunia antara tahun 1875 dan 1915. Penemuan endapan besar di Basin Sudbury, Kanada pada tahun 1883, di Norilsk-Talnakh, Rusia pada tahun 1920, dan di Terumbu Merensky, Afrika Selatan pada tahun 1924, memungkinkan produksi nikel dalam skala besar.[44] Penggunaan dalam koin Selain koin Baktria yang sudah disebutkan di atas, nikel belum digunakan sebagai komponen koin sampai pertengahan abad ke-19.[butuh rujukan] Kanada99,9% koin nikel lima sen digunakan di Kanada (produsen nikel terbesar di dunia pada saat itu) selama tahun-tahun non-perang dari 1922 hingga 1981; kandungan logam membuat koin-koin ini bermagnetik.[51] Selama periode perang 1942-1945, sebagian besar atau semua nikel dikeluarkan dari koin Kanada dan AS untuk disimpan untuk pembuatan baju zirah dari besi.[52] Kanada menggunakan 99,9% nikel dari tahun 1968 dengan koin bernilai lebih tinggi hingga tahun 2000.[53] SwissKoin nikel yang hampir murni pertama kali digunakan pada tahun 1881 di Swiss.[54] Britania RayaBirmingham telah membuat koin nikel sekitar tahun 1833 untuk diperdagangkan di Malaysia.[55] Amerika SerikatDi Amerika Serikat, istilah "nikel" atau "nikel" awalnya diterapkan pada sen tembaga-nikel Flying Eagle, yang menggantikan tembaga dengan 12% nikel pada tahun 1857–1858, kemudian sen Kepala India menggunakan paduan yang sama dari tahun 1859 hingga 1864. Pada tahun 1865, nikel tiga sen mulai dibuat, dengan kandungan nikel meningkat menjadi 25%. Pada tahun 1866, nikel perisai lima sen (25% nikel, 75% tembaga) sudah menyesuaikan dengan penunjukannya. Seiring dengan proporsi paduan, istilah ini telah digunakan hingga saat ini di Amerika Serikat.[butuh rujukan] Penggunaan saat iniPada abad ke-21, harga nikel yang tinggi telah menyebabkan beberapa penggantian logam pada koin di seluruh dunia. Koin yang masih dibuat dengan paduan nikel adalah koin satu dan dua euro, koin 5¢, 10¢, 25¢, dan 50¢ Amerika Serikat, dan koin 20p, 50p, £1, dan £2 Britania Raya. Paduan nikel dalam koin 5p dan 10p Inggris diganti dengan baja berlapis nikel mulai tahun 2012, yang menyebabkan masalah alergi nikel bagi sebagian orang dan kontroversi publik.[54] Produksi nikel 3,6 juta ton (t) nikel per tahun diperkirakan diproduksi di seluruh dunia. Negara produsen nikel terbesar pada tahun 2022 meliputi Indonesia (1.800.000 t), Filipina (400.000 t), Rusia (200.000 t), Kaledonia Baru (230.000 t), Kanada (180.000 t), dan Australia (160.000 t).[57] Deposit nikel terbesar di Eropa (selain Rusia) terletak di Finlandia dan Yunani. Sumber daya yang telah diidentifikasi dengan rata-rata 1% nikel atau lebih mengandung setidaknya 130 juta ton nikel. Kira-kira 60% ada di dalam mineral laterit dan 40% berada di dalam endapan sulfida. Selain itu, sumber daya nikel di dalam laut terdapat di kerak mangan yang mencakupi sebagian besar dasar laut, terutama di sebuah daerah di Samudra Pasifik bernama Zona Clarion Clipperton dalam bentuk nodul polimetalik yang tercecer di dasar laut pada kedalaman 3,5–6 km di bawah permukaan laut.[58][59] Nodul ini terdiri dari berbagai logam tanah jarang dan perkiraan kandungan nikel dari nodul ini adalah 1,7%.[60] Dengan kemajuan dalam sains modern dan teknik, saat ini regulasi sedang ditetapkan oleh Otoritas Dasar Laut Internasional untuk memastikan bahwa pengumpulan nodul ini tidak merusak lingkungan dan mematuhi Tujuan Pembangunan Berkelanjutan oleh Perserikatan Bangsa-Bangsa.[61]  Satu-satunya tempat di Amerika Serikat di mana nikel telah ditambang secara menguntungkan adalah Riddle, Oregon, di mana ada beberapa mil persegi endapan permukaan garnierit yang mengandung nikel. Tambang ditutup pada tahun 1987.[62][63] Proyek pertambangan Eagle adalah sebuah pertambangan nikel baru di semenanjung Michigan. Pembangunan selesai pada tahun 2013, dan telah dioperasikan sejak kuartal ketiga 2014.[64] Pada tahun operasi penuh pertama, pertambangan Eagle telah memproduksi 18.000 t.[64] Pengolahan nikel Nikel diperoleh melalui metalurgi ekstraktif: nikel diekstraksi dari bijih dengan proses pemanggangan dan reduksi konvensional yang menghasilkan logam dengan kemurnian 75%. Untuk banyak penggunaan baja tahan karat, kemurnian 75% dapat digunakan tanpa pemurnian lebih lanjut, tergantung pada pengotornya.[butuh rujukan]  Pada proses tradisional, sebagian besar bijih sulfida diproses menggunakan proses pirometalurgi untuk menghasilkan matte untuk pemurnian lebih lanjut. Kemajuan terbaru dalam teknik hidrometalurgi menghasilkan logam nikel yang jauh lebih murni. Pada proses tradisional, sebagian besar endapan sulfida diproses dengan konsentrasi melalui proses flotasi buih yang diikuti dengan ekstraksi pirometalurgi. Dalam proses hidrometalurgi, bijih nikel sulfida dikonsentrasikan dengan flotasi (flotasi diferensial jika rasio Ni/Fe terlalu rendah) dan kemudian dilebur. Nikel mattenya diproses lebih lanjut dengan proses Sherritt-Gordon. Pertama, tembaga dihilangkan dengan menambahkan hidrogen sulfida, yang meninggalkan konsentrat kobalt dan nikel. Kemudian, ekstraksi pelarut digunakan untuk memisahkan kobalt dan nikel, dengan kemurnian nikel lebih dari 99%. ElectrorefiningProses pemurnian umum yang kedua adalah pencucian matte logam ke dalam larutan garam nikel, diikuti dengan perolehan nikel elektrolitik dari larutan dengan melapiskannya ke katode sebagai nikel elektrolitik. Proses Mond Logam termurni diperoleh dari nikel oksida melalui proses Mond, dengan kemurnian lebih dari 99,99%.[65] Prosesnya dipatenkan oleh Ludwig Mond dan telah digunakan dalam industri sejak awal abad ke-20. Dalam proses ini, nikel direaksikan dengan karbon monoksida dengan katalis belerang pada suhu sekitar 40–80 °C untuk membentuk nikel karbonil. Besi menghasilkan besi pentakarbonil, tetapi reaksi ini memerlukan waktu yang lama. Jika perlu, nikel dapat dipisahkan dengan distilasi. Dikobalt oktakarbonil juga dibentuk dalam distilasi nikel sebagai produk sampingan, tetapi terurai menjadi tetrakobalt dodekakarbonil pada suhu reaksi untuk menghasilkan padatan yang tidak mudah menguap.[66] Nikel diperoleh dari nikel karbonil melalui salah satu dari dua proses. Pada proses pertama, nikel karbonil dilewatkan melalui ruang besar pada suhu tinggi di mana puluhan ribu bola nikel, yang disebut pelet, diaduk secara terus-menerus. Karbonil terurai dan mendepositkan nikel murni ke dalam bola nikel. Pada proses kedua, nikel karbonil diuraikan dalam ruang kecil pada suhu 230 °C untuk menghasilkan bubuk nikel yang halus. Hasil samping karbon monoksida disirkulasi ulang dan digunakan kembali. Produk nikel yang sangat murni dikenal sebagai "karbonil nikel".[67] Nilai logamHarga pasar nikel melonjak sepanjang tahun 2006 dan awal bulan 2007; pada 5 April 2007, logam tersebut diperdagangkan dengan harga US$52.300/ton atau $52,3/kg (Rp 475.530/kg).[68] Harga kemudian turun secara dramatis, dan pada September 2017, logam tersebut diperdagangkan pada $11.000/ton, atau $11/kg (Rp 145.750/kg).[69] Koin nikel AS mengandung 1,1 g nikel, bernilai 6,5 sen (Rp 590) pada April 2007, bersama dengan 3,75 gram tembaga senilai sekitar 3 sen (Rp 270), dengan total nilai logam lebih dari 9 sen (diatas Rp 800). Karena nilai nominal nikel adalah 5 sen (Rp 455), koin nikel menjadi target yang menarik untuk dilebur oleh orang-orang yang ingin menjual logam dengan keuntungan. Namun, United States Mint, untuk mengantisipasi target ini, menerapkan aturan sementara baru pada 14 Desember 2006, untuk komentar publik selama 30 hari, yang mengkriminalisasi pencairan dan ekspor koin sen dan nikel.[70] Pelanggar dikenakan denda hingga $10.000 dan atau penjara maksimal lima tahun.[butuh rujukan] Pada tanggal 19 September 2013, nilai logam dalam koin nikel AS (termasuk tembaga dan nikel) adalah $0,045 (Rp 513), 90% dari nilai nominal (Rp 570).[71] Pengolahan melalui pirometalurgiBerdasarkan tahapan proses, pengolahan nikel dapat dilakukan dalam tiga tahapan proses, yaitu preparasi, pemisahan, dan pewatering. Kegiatan pengolahan ini bertujuan untuk membebaskan dan memisahkan mineral berharga dari mineral yang tidak berharga atau mineral pengotor sehingga setelah dilakukan proses pengolahan dihasilkan konsentrat yang bernilai tinggi dan tailing yang tidak berharga. Metode yang dipakai bermacam-macam tergantung dari sifat kimia, sifat fisika, sifat mekanik dari mineral itu sendiri.[5] Secara umum, mineral bijih di alam ini dibagi dalam 2 (dua) jenis yaitu mineral sulfida dan mineral oksida. Begitu pula dengan bijih nikel, ada sulfida dan ada oksida. Masing-masing mempunyai karakteristik sendiri dan cara pengolahannya pun juga tidak sama. Dalam bahasan kali ini akan dibatasi pengolahan bijih nikel dari mineral oksida (laterit).[5] Bijih nikel dari mineral oksida (laterit) ada dua jenis yang umumnya ditemui yaitu saprolit dan limonit dengan berbagai variasi kadar. Perbedaan menonjol dari 2 jenis bijih ini adalah kandungan besi dan magnesium. Bijih saprolit mempunyai kandungan besi rendah dan magnesium tinggi sedangkan limonit sebaliknya. Bijih saprolit dibagi menjadi 2 berdasarkan kadarnya, yaitu HGSO (High Grade Saprolit Ore) dan LGSO (Low Grade Saprolit Ore), biasanya HGSO mempunyai kadar nikel ≥ 2% sedangkan LGSO mempunyai kadar nikel < 2%. Adapun tahap-tahap yang dilakukan untuk melakukan proses pengolahan nikel melalui beberapa tahap utama yaitu, crushing, pengering, pereduksi, peleburan, pemurni, dan granulasi dan pengemasan.[5] KominusiKominusi adalah suatu proses untuk mengubah ukuran suatu bahan galian menjadi lebih kecil, hal ini bertujuan untuk memisahkan atau melepaskan bahan galian tersebut dari mineral pengotor yang melekat bersamanya.[5][5] Kominusi bahan galian meliputi kegiatan berikut:
SizingMerupakan proses pemilahan bijih yang telah melalui proses kominusi sesuai ukuran yang dibutuhkan. Kegiatan sizing meliputi screening yaitu pemisahan berdasarkan ukuran.[5] Sizing dibagi menjadi dua, antara lain: Pengayakan/penyaringanPengayakan atau penyaringan (screening/sieving) adalah proses pemisahan secara mekanik berdasarkan perbedaan ukuran partikel. Pengayakan (screening) dipakai dalam skala industri, sedangkan penyaringan (sieving) dipakai untuk skala laboratorium.[5] Produk dari proses pengayakan/penyaringan ada 2 (dua), yaitu antara lain:
Saringan (sieve) yang sering dipakai di laboratorium yaitu antara lain:
Sedangkan ayakan (screen) yang berskala industri yaitu antara lain:
KlasifikasiKlasifikasi (classification) adalah proses pemisahan partikel berdasarkan kecepatan pengendapannya dalam suatu media (udara atau air). Klasifikasi dilakukan dalam suatu alat yang disebut classifier.[5] Produk dari proses klasifikasi ada 2 (dua), yaitu antara lain:
Proses pemisahan dalam classifier dapat terjadi dalam tiga cara (concept), yaitu:
PengeringanPengeringan (drying) adalah proses untuk membuang seluruh kandung air dari padatan yang berasal dari konsentrat dengan cara penguapan (evaporization/evaporation).[5] Peralatan atau cara yang dipakai ada bermacam-macam, yaitu antara lain:
Kalsinasi dan reduksi di tanur pereduksiTujuannya untuk menghilangkan kandungan air di dalam bijih, mereduksi sebagian nikel oksida menjadi nikel logam, dan sulfidasi. Setelah proses drying selesai, bijih nikel yang tersimpan di gudang bijih kering pada dasarnya belumlah kering secara sempurna, karena itulah tahapan ini bertujuan untuk menghilangkan kandungan air bebas dan air kristal serta mereduksi nikel oksida menjadi nikel logam. Proses ini berlangsung dalam tanur reduksi. Bijih dari gudang dimasukkan dalam tanur reduksi dengan komposisi pencampuran menggunakan ratio tertentu untuk menghasilkan komposisi silika magnesia dan besi yang sesuai dengan operasional tanur listrik. Selain itu dimasukkan pula batubara yang berfungsi sebagai bahan pereduksi pada tanur reduksi maupun pada tanur pelebur. Untuk mengikat nikel dan besi reduksi yang telah tereduksi agar tidak teroksidasi kembali oleh udara maka ditambahkanlah belerang. Hasil akhir dari proses ini disebut kalsin yang bertemperatur sekitar 7000 °C.[5] Peleburan di tanur listrikUntuk melebur kalsin hasil kalsinasi/reduksi sehingga terbentuk fasa lelehan matte dan slag. Kalsin panas yang keluar dari tanur reduksi sebagai umpan tanur pelebur dimasukkan kedalam surge bin lalu kemudian dibawa dengan transfer car ke tempat penampungan. Furnace bertujuan untuk melebur kalsin hingga terbentuk fase lelehan matte dan slag. Dinding furnace dilapisi dengan batu tahan api yang didinginkan dengan media air melalui balok tembaga. Matte dan slag akan terpisah berdasarkan berat jenisnya. Slag kemudian diangkut ke lokasi pembuangan dengan kendaraan khusus.[5] Pengkayaan di tanur pemurniBertujuan untuk menaikkan kadar Ni di dalam matte dari sekitar 27% menjadi di atas 75%. Matte yang memiliki berat jenis lebih besar dari slag diangkut ke tanur pemurni / converter untuk menjalani tahap pemurnian dan pengayaan. Proses yang terjadi dalam tanur pemurni adalah peniupan udara dan penambahan silika. Silika ini akan mengikat besi oksida dan membentuk ikatan yang memiliki berat jenis lebih rendah dari matte sehingga menjadi mudah untuk dipisahkan.[5] Granulasi dan pengemasanUntuk mengubah bentuk matte dari logam cair menjadi butiran-butiran yang siap diekspor setelah dikeringkan dan dikemas. Matte dituang kedalam tandis sembari secara terus menerus disemprot dengan air bertekanan tinggi. Proses ini menghasilkan nikel matte yang dingin yang berbentuk butiran-butiran halus. Butiran-butiran ini kemudian disaring, dikeringkan dan siap dikemas.[5] Penggunaan Saat ini, nikel digunakan sebagai berikut: 68% digunakan untuk baja tahan karat; 10% dalam paduan nonferrous; 9% dalam pelapisan listrik; 7% dalam baja paduan; 3% di pengecoran; dan 4% digunakan dalam penggunaan lainnya (termasuk baterai).[10] Banyak produk menggunakan nikel, termasuk baja tahan karat, magnet alnico, koin, baterai isi ulang, senar gitar listrik, kapsul mikrofon, pelapisan pipa,[72] dan paduan khusus seperti permaloi, elinvar, dan invar. Nikel digunakan untuk pelapisan dan sebagai pewarna hijau di kaca. Nikel sebagian besar merupakan logam paduan, dan penggunaan utamanya adalah pada baja nikel dan besi cor nikel, yang biasanya meningkatkan kekuatan tarik, ketangguhan, dan batas elastis. Nikel banyak digunakan di paduan lainnya, termasuk kuningan nikel dan perunggu dan paduan dengan tembaga, kromium, aluminium, timbal, kobalt, perak, dan emas (Inconel, Incoloy, Monel, Nimonic).[73]  Karena ketahanannya terhadap korosi, nikel kadang digunakan sebagai pengganti perak dalam penggunaan dekoratif. Nikel juga kadang digunakan di beberapa negara setelah tahun 1859 sebagai logam koin murah (lihat di bagian Penggunaan dalam koin), tetapi pada abad ke-20, nikel digantikan dengan paduan baja tahan karat (yaitu besi) yang lebih murah, kecuali di Amerika Serikat dan Kanada.[74] Nikel adalah agen paduan yang sangat baik untuk logam mulia tertentu dan digunakan dalam uji api sebagai pengumpul elemen dalam golongan platina. Dengan demikian, nikel mampu mengumpulkan sepenuhnya keenam elemen dalam golongan platina dari bijih, dan mengumpulkan sebagian emas. Tambang nikel besar dapat terlibat dalam pemulihan elemen dalam golongan platina (terutama platina dan paladium); contohnya di Norilsk di Rusia dan Basin Sudbury di Kanada. Busa nikel atau jaring nikel digunakan dalam elektroda untuk difusi gas untuk sel tunam alkali.[75][76] Nikel dan paduannya sering digunakan sebagai katalis untuk reaksi hidrogenasi. Nikel Raney, paduan nikel-aluminium yang terbagi dengan halus, merupakan salah satu bentuk umum, meskipun katalis terkait juga digunakan, termasuk katalis tipe Raney. Nikel adalah bahan magnetostriktif alami, artinya, jika ada medan magnet, bahan tersebut mengalami sedikit perubahan panjang.[77][78] Magnetostriksi nikel sekitar -50 ppm, yang menunjukkan bahwa nikel berkontraksi. Nikel digunakan sebagai pengikat dalam industri semen wolfram karbida atau logam keras dan digunakan dalam proporsi 6% sampai 12% berat. Nikel membuat wolfram karbida bermagnet dan menambah ketahanan korosi pada bagian yang disemen, meskipun kekerasannya lebih kecil dibandingkan dengan pengikat kobalt.[79] 63Ni, dengan waktu paruh 100,1 tahun, berguna dalam perangkat krytron sebagai pemancar partikel beta (elektron berkecepatan tinggi) untuk membuat ionisasi dengan elektroda tetap-hidup lebih andal.[80][81][82] Sekitar 27% dari semua produksi nikel ditujukan untuk teknik, 10% untuk bangunan dan konstruksi, 14% untuk produk tubular, 20% untuk barang logam, 14% untuk transportasi, 11% untuk barang elektronik, dan 5% untuk penggunaan lain.[10] Paduan nikel Raney banyak digunakan untuk hidrogenasi minyak tak jenuh untuk membuat margarin. Margarin buruk dan minyak sisa mungkin mengandung nikel sebagai kontaminan. Forte dkk. menemukan bahwa pasien diabetes tipe 2 memiliki 0,89[82] ng/ml Ni dalam darah dibandingkan dengan 0,77[82] ng/ml pada subjek kontrol.[83] Paduan nikel
Peranan biologisWalaupun tidak diketahui sampai tahun 1970-an, nikel memiliki peran penting dalam kehidupan beberapa tumbuhan, eubacteria, archaebacteria, dan jamur.[84][85][86] Enzim nikel seperti urease dianggap sebagai faktor virulensi pada beberapa organisme.[87][88] Urease mengkatalisis hidrolisis urea untuk membentuk amonia dan karbamat.[84][85] Hidrogenase NiFe dapat mengkatalisis oksidasi H2 untuk membentuk proton dan elektron, dan juga dapat mengkatalisis reaksi balik, yaitu reduksi proton untuk membentuk gas hidrogen.[84][85] Sebuah koenzim nikel-tetrapirrol, kofaktor F430, ada dalam metil koenzim M reduktase, yang dapat mengkatalisis pembentukan metana, atau reaksi sebaliknya, dalam arkea metanogenik (dalam keadaan oksidasi +1).[89] Salah satu enzim dehidrogenase karbon monoksida terdiri dari gugus Fe-Ni-S.[90] Enzim pembawa nikel lainnya termasuk kelas bakteri langka enzim superoksida dismutase[91] dan glioksalase I pada bakteri dan beberapa parasit trypanosomal eukariotik[92] (pada organisme tingkat tinggi, termasuk ragi dan mamalia, enzim ini mengandung Zn2+ divalen).[93][94][95][96][97] Nikel dari makanan dapat mempengaruhi kesehatan manusia melalui infeksi dari bakteri yang bergantung pada nikel, tetapi nikel mungkin merupakan nutrisi penting untuk bakteri yang berada di usus besar, yang berfungsi sebagai prebiotik.[98] US Institute of Medicine belum mengkonfirmasi bahwa nikel adalah nutrisi penting bagi manusia, oleh karena itu, Asupan Kebutuhan Gizi (AKG) maupun Asupan yang Memadai belum ditetapkan. Batas Atas Asupan dari nikel dari makanan adalah 1000 µg/hari sebagai garam nikel terlarut. Asupan nikel dari makanan diperkirakan adalah 70 sampai 100 µg/hari, dari itu, kurang dari 10% diserap. Apa yang diserap diekskresikan dalam urine.[99] Jumlah nikel yang relatif besar - sebanding dengan perkiraan konsumsi rata-rata di atas - melindi ke dalam makanan yang dimasak dalam panci stainless steel. Contohnya, jumlah nikel yang terlindi setelah satu porsi saus tomat dimasak 10 kali rata-rata 88 µg.[100][101] Nikel yang dilepaskan dari letusan gunung berapi di Siberian Traps diduga membantu pertumbuhan Methanosarcinales, yaitu genus arkaea euryarchaeote yang menghasilkan metana selama peristiwa kepunahan Perm-Trias, peristiwa kepunahan terbesar yang pernah tercatat.[102] Toksisitas
Sumber utama paparan nikel adalah konsumsi oral, karena nikel sangat penting bagi tanaman.[104] Nikel ditemukan secara alami dalam makanan dan air, dan dapat meningkat jumlahnya karena polusi manusia. Misalnya, keran berlapis nikel dapat mencemari air dan tanah; air limbah industri pertambangan dan peleburan dapat mengandung nikel; makanan dimasak dengan peralatan masak paduan baja nikel atau disajikan di piring berpigmen nikel dapat mengandung nikel. Atmosfer mungkin tercemar oleh industri pemurnian bijih nikel dan pembakaran bahan bakar fosil. Manusia dapat menyerap nikel langsung dari asap rokok dan kontak kulit dengan perhiasan, sampo, deterjen, dan koin. Bentuk paparan kronis yang kurang umum adalah melalui hemodialisis karena jejak ion nikel dapat diserap ke dalam plasma dari aksi pengelatan albumin.[butuh rujukan] Paparan harian rata-rata tidak menimbulkan ancaman bagi kesehatan manusia. Sebagian besar nikel yang diserap setiap hari oleh manusia dikeluarkan oleh ginjal dan dikeluarkan dari tubuh melalui urine atau dibuang melalui saluran pencernaan tanpa diserap. Nikel bukanlah racun kumulatif, tetapi dosis yang lebih besar atau paparan inhalasi kronis mungkin berbahaya, bahkan karsinogenik, dan menimbulkan bahaya pekerjaan.[105] Senyawa nikel diklasifikasikan sebagai karsinogen manusia[106][107][108][109] berdasarkan peningkatan risiko kanker pernapasan yang diamati dalam studi epidemiologi pekerja penyulingan bijih sulfida.[110] Hal ini didukung oleh hasil positif dari bioassay NTP dengan sub-sulfida Ni dan Ni oksida pada tikus.[111][112] Data manusia dan hewan menunjukkan tidak adanya karsinogenisitas melalui konsumsi oral dan karsinogenisitas terbatas senyawa nikel yang menyebabkan tumor pernapasan setelah terhirup.[113][114] Logam nikel diduga sebagai karsinogen;[106][107][108] ada konsistensi antara risiko kanker pernapasan normal pada pekerja yang sebagian besar terpapar nikel logam[110] dan tidak adanya tumor pernapasan pada studi karsinogenisitas dengan inhalasi nikel pada tikus dengan bubuk logam nikel.[115] Dalam studi inhalasi hewan pengerat dengan berbagai senyawa nikel dan logam nikel, peningkatan peradangan paru dengan dan tanpa hiperplasia atau fibrosis kelenjar getah bening bronkial diamati.[109][111][115][116] Dalam penelitian dengan tikus, konsumsi oral garam nikel terlarut dalam air dapat menyebabkan kematian perinatal pada hewan hamil.[117] Apakah efek ini relevan dengan manusia masih belum jelas karena studi epidemiologi pada pekerja wanita yang terpapar nikel belum menunjukkan efek toksisitas perkembangan yang merugikan.[118][119][120][121] Orang dapat terpapar nikel di tempat kerja melalui penghirupan, konsumsi, dan kontak dengan kulit atau mata. Administrasi Keselamatan dan Kesehatan Kerja (OSHA) telah menetapkan batas legal (batas paparan yang diizinkan) dalam tempat kerja sebesar 1 mg/m3 per 8 jam kerja, kecuali nikel karbonil. National Institute for Occupational Safety and Health (NIOSH) menetapkan batas paparan yang direkomendasikan (REL) sebesar 0,015 mg/m3 per 8 jam hari kerja. Pada 10 mg/m3, nikel berbahaya bagi kehidupan dan kesehatan.[122] Nikel karbonil [Ni(CO)4] adalah gas yang sangat beracun. Toksisitas karbonil logam berasal dari toksisitas logam dan pembuangan gas karbon monoksida dari gugus fungsi karbonil; nikel karbonil juga mudah meledak di udara.[123][124] Orang yang sensitif mungkin menunjukkan alergi kontak kulit terhadap nikel yang dikenal sebagai dermatitis kontak. Orang yang sangat sensitif juga dapat bereaksi terhadap makanan dengan kandungan nikel yang tinggi.[125] Sensitivitas terhadap nikel juga dapat ditemukan pada pasien dengan pompholyx. Nikel adalah alergen kontak yang paling banyak dialami orang di seluruh dunia, sebagian alerginya karena penggunaannya dalam perhiasan untuk tindik telinga.[126] Alergi nikel yang mempengaruhi telinga yang ditindik sering kali ditandai dengan kulit yang merah dan gatal. Sekarang, banyak anting dibuat tanpa nikel atau nikel rendah lindi[127] untuk mengatasi masalah ini. Jumlah yang diperbolehkan dalam produk yang bersentuhan dengan kulit manusia sekarang diatur dalam Uni Eropa. Pada tahun 2002, para peneliti menemukan bahwa nikel yang terlindi oleh koin 1 dan 2 Euro jauh melebihi standar tersebut. Ini diyakini sebagai hasil dari reaksi galvanik.[128] Nickel terpilih sebagai Allergen of the Year pada tahun 2008 oleh American Contact Dermatitis Society.[129] Pada Agustus 2015, American Academy of Dermatology menyatakan tentang keamanan nikel: "Diperkirakan bahwa dermatitis kontak, yang mencakup sensitisasi nikel, menyumbang sekitar $1,918 miliar (sekitar Rp 25,8 triliun) dan mempengaruhi hampir 72,29 juta orang."[125] Laporan menunjukkan bahwa aktivasi faktor induksi hipoksia (HIF-1) yang diinduksi nikel dan peningkatan regulasi gen yang diinduksi hipoksia disebabkan oleh penipisan askorbat intraseluler. Penambahan askorbat ke media kultur meningkatkan level askorbat intraseluler dan membalikkan stabilisasi yang diinduksi logam dari ekspresi gen yang bergantung pada HIF-1 dan HIF-1α.[130][131] Lihat pulaReferensi
Pranala luarWikimedia Commons memiliki media mengenai Nikel.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||





